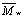 ,
неэлектролита при выходе кривой на плато в области больших
,
неэлектролита при выходе кривой на плато в области больших 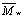 ,
(Сабиров и др.,1991, Krasilnikov et. al., 1992). Однако при такой
оценке не учитывается полидисперсность коммерческих препаратов
полимеров, которая в основном и определяет диапазон плавной зависимости
измеряемого параметра от
,
(Сабиров и др.,1991, Krasilnikov et. al., 1992). Однако при такой
оценке не учитывается полидисперсность коммерческих препаратов
полимеров, которая в основном и определяет диапазон плавной зависимости
измеряемого параметра от 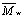 . 1. Исходя
из реальной дисперсии ПЭГ мы показали, что диаметру канала (поры)
соответствует средний радиус rg, молекул такого
ПЭГ, когда пора заполнена его легкими фракциями на 65-70%. Неучет
полидисперсности ПЭГ приводит к завышенной, до 35%, оценки диаметра
пор.
. 1. Исходя
из реальной дисперсии ПЭГ мы показали, что диаметру канала (поры)
соответствует средний радиус rg, молекул такого
ПЭГ, когда пора заполнена его легкими фракциями на 65-70%. Неучет
полидисперсности ПЭГ приводит к завышенной, до 35%, оценки диаметра
пор. 2. С учетом дисперсности ПЭГ мы определили эффективный диаметр катионных (кальциевых) каналов из клеток водоросли Nitellopsis, реконструированных в бислойной липидной мембране. Эти каналы имеют кластерную организацию, т.е. образованы комплексом из протоканалов. Поэтому ожидалось, что каналы-кластеры с разной проводимостью, (разным числом протоканалов в кластере) будут иметь одно и тоже значение rg, соответствующее радиусу протоканала. Измерения проводились с каналами проводимостью 100 и 350 пСм (в 0,1 MKCl). Эффективный радиус канала с низкой проводимостью оказался равным 0,63 нм. (по ранее принятой методике оценки - 0,87 нм). Зависимость тока канала 350 пСм от
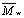 полимера имеет, в отличие от низкопроводящего канала, промежуточное
плато. Предполагается, что оно связано с наличием узкого места
с радиусом около 0,48 нм в структуре канала, в то время как радиус
вестибюля практически совпадает с таковым канала первого типа.
Через оба канала проходят ионы тетраэтиламмония (кристаллический
радиус 0,4 нм). 3. Для сопоставления геометрических параметров
реконструированного канала с Са2+-каналом нативной
клетки Chara corallina изучали влияние ПЭГ во внешнем растворе
на переходный ток этих каналов в режиме фиксации потенциала на
клетке. Вместо ожидаемого увеличения амплитуды тока с ростом
полимера имеет, в отличие от низкопроводящего канала, промежуточное
плато. Предполагается, что оно связано с наличием узкого места
с радиусом около 0,48 нм в структуре канала, в то время как радиус
вестибюля практически совпадает с таковым канала первого типа.
Через оба канала проходят ионы тетраэтиламмония (кристаллический
радиус 0,4 нм). 3. Для сопоставления геометрических параметров
реконструированного канала с Са2+-каналом нативной
клетки Chara corallina изучали влияние ПЭГ во внешнем растворе
на переходный ток этих каналов в режиме фиксации потенциала на
клетке. Вместо ожидаемого увеличения амплитуды тока с ростом 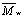 полиэтилен-гликоля (ПЭГ) наблюдали его резкое уменьшение вплоть
до нулевого значения в районе ПЭГ 1450. Предполагается, что это
падение амплитуды переходного тока обусловлено уменьшением времени
жизни каналов в открытом состоянии под влиянием осмотического
стресса. 4. На изолированном отрезке клеточной оболочки
водоросли Chara corallina ("тени"), заполненном
непроникающим через неё ПЭГ 6000, из осмотических измерений установили,
что Mt даже у молодых клеток водоросли не превышает
1050 Да, что соответствует максимальному диаметру пор в клеточной
оболочке размером около 2,1 нм. Работа выполнена при поддержке
РФФИ (проекты № 96-04-48297 и № 99-04-48553).
полиэтилен-гликоля (ПЭГ) наблюдали его резкое уменьшение вплоть
до нулевого значения в районе ПЭГ 1450. Предполагается, что это
падение амплитуды переходного тока обусловлено уменьшением времени
жизни каналов в открытом состоянии под влиянием осмотического
стресса. 4. На изолированном отрезке клеточной оболочки
водоросли Chara corallina ("тени"), заполненном
непроникающим через неё ПЭГ 6000, из осмотических измерений установили,
что Mt даже у молодых клеток водоросли не превышает
1050 Да, что соответствует максимальному диаметру пор в клеточной
оболочке размером около 2,1 нм. Работа выполнена при поддержке
РФФИ (проекты № 96-04-48297 и № 99-04-48553).